Цитопатическое действие вируса гепатита с на гепатоциты
Содержание статьи
Молекулярные механизмы развития вирусных гепатитов

К основным функциям печени можно отнести метаболизм поступающих в организм веществ, продукцию различных белков и обезвреживание токсических соединений. Кровь, в которую всасываются продукты расщепления пищи, по воротной вене поступает в печень, где осуществляется ликвидация антигенов. При этом механизмы элиминации чужеродных соединений протекают наряду с толерантностью к пищевым антигенам. Этот тонкий баланс требует постоянного функционирования четко отрегулированной локальной системы иммунитета в печени. Среда, поддерживаемая в печени, отчасти может способствовать толерогенным свойствам некоторых антигенов, которые хорошо к ней приспосабливаются. К патогенам, имеющим сродство к ткани печени, можно отнести такие гепатотропные вирусы, как вирусы гепатита В и С (HBV, HCV), вызывающие развитие воспалительных реакций (как острого воспаления, так и персистирующей инфекции) в печени. Хроническая инфекция может стать впоследствии причиной цирроза печени и развития злокачественных новообразований.
Вирусные гепатиты характеризуются гибелью гепатоцитов и клеток паренхимы печени. Однако вирусы гепатита В и С не обладают прямым цитопатическим действием, а потому нельзя сказать, что смерть инфицированных гепатоцитов вызвана непосредственно вирусом. Вместо этого, данные вирусы опосредуют повреждение печени путем инициирования противовирусного иммунного ответа, определяющего течение заболевания.
Начальный этап иммунного ответа затрагивает врожденные механизмы, неспецифически распознающие вирус и препятствующие его распространению. Данные защитные механизмы включают в себя запуск апоптоза инфицированных клеток, содержащих вирусные частицы, выработку противовирусных цитокинов, что препятствует репликации вируса. Также в ходе репликации вируса в зараженных им клетках накапливаются вирусные белки, нуклеиновые кислоты, готовые вирусные частицы, которые нарушают клеточный гомеостаз. Клетка реагирует на подобные изменения запуском стрессорных реакций, целью которых является восстановить прежние физиологические условия среды. Если же это уже не представляется возможным, то в клетке запускается программа клеточной смерти. Таким образом, вирус может напрямую вызывать гибель зараженной клетки.
Также вирусы могут быть обнаружены компонентами системы врожденного иммунитета на основе высококонсервативных вирусных структур, называемых патоген-ассоциированными молекулярными паттернами (pathogen associated molecular pattern, PAMP). К PAMP относятся, к примеру, (глико)протеины на поверхности вируса и вирусные нуклеиновые кислоты, которые выявляются при помощи иммунных рецепторов — PRR (pattern recognition receptor) — которые можно подразделить на мембраносвязанные толл-подобные рецепторы (TLR, toll-like receptors) и цитозольные сенсоры нуклеиновых кислот. Кроме того, TLR экспрессируются не только иммунными клетками (хотя ими преимущественно), но и гепатоцитами. Эти рецепторы располагаются как в плазматической, так и в эндосомальных мембранах, и потому могут узнавать и внеклеточные компоненты вируса, и продукты вирусной активности, поглощенные клетками. Цитозольные сенсоры нуклеиновых кислот, напротив, экспрессируются практически всеми типами клеток. К ним можно отнести RIG-I-подобные рецепторы (среди них — RIG-I, MDA5, распознающие вирусную РНК). Вирусная ДНК распознается такими сенсорами, как STING и NLRP3. Стимуляция рецепторов, распознающих экзогенные структуры, ведет к активации 3-х сигнальных путей: 1) активация фактора транскрипции NFκB, который опосредует выработку воспалительных цитокинов (фактор некроза опухоли, интерлейкины (в частности, IL-6)); 2) синтез и выделение интерферонов I типа (IFNα и β), которые связываются с рецепторами IFNα (IFNAR) и инициируют транскрипцию интерферон-стимулированных генов; 3) активация инфламмасом — мультипротеинового комплекса, в котором активна протеаза каспаза 1, которая обеспечивает созревание цитокинов IL-1ß и IL-18. Таким образом, стимуляция иммунных рецепторов в целом, будь то TLR или сенсоры нуклеиновых кислот, имеет противовирусное, воспалительное и иммуностимулирующее действие. Активность иммунных рецепторов и продукция воспалительных цитокинов обеспечивает активацию и рекрутинг клеток врожденной иммунной системы: кроме прочих, сюда относятся и антиген-презентирующие клетки, необходимые для последующего запуска адаптивного иммунного ответа. С помощью молекул MHC I и II эти клетки представляют антигены клеткам системы специфического иммунитет, чтобы привести их в активное состояние. Таким образом, за счет неспецифического иммунного ответа начинается подготовка для вступления в действие системы адаптивного иммунного ответа, благодаря которой вирусные антигены специфически выявляются и запускаются реакции, направленные на их устранение.
Центральная роль в элиминации гепатотропных вирусов принадлежит вирусоспецифическим цитотоксическим Т-лимфоцитам (cytotoxic T-cell, CTL), а именно, Т-клеткам, относящимся к субпопуляции CD8+. Они берут на себя различные эффекторные функции, среди которых можно выделить нецитолитические (после уничтожения вируса клетка остается жизнеспособной) и цитотоксические (клетка уничтожается вместе с вирусом). Именно за счет цитотоксических эффекторных функций CTL определяют объем поражения печени и картину течения вирусных гепатитов. Нецитолитическая борьба против вируса осуществляет посредством продукции цитокинов (например, IFN-γ), которые сдерживают репликацию вируса в гепатоцитах. Кроме того, воспалительные цитокины участвуют в активации и рекрутинге других иммунных клеток — нейтрофилов, макрофагов, дендритных клеток, NK-клеток, и, таким образом, они вторично опосредуют усиление повреждения печени. Цитотоксические функции CTL реализуются путем запуска сигнала апоптоза связыванием лиганда Fas, который экспрессируется на поверхности CTL, с рецептором Fas, который расположен на пораженных вирусом клетках печени. Экспрессия белка Fas инфицированными гепатоцитами может быть усилена за счет IFN-γ, что указывает на взаимосвязь различных по своей природе эффекторных функций Т-лимфоцитов. Также цитотоксические реакции запускаются CTL вследствие выделения гранул с перфорином и гранзимом. Эти молекулы поглощаются клетками и ведут к инициации каспаза-зависимого и -независимого путей развития клеточной смерти. Чтобы обеспечить целенаправленное, специфическое цитотоксическое воздействие, необходим непосредственный контакт между CTL и клетками-мишенями, для чего молекулы MHC I презентируют вирусный антиген, распознаваемый Т-клеточными рецепторами. Однако в экспериментальных культурах гепатоцитов было обнаружено и не каноничное воздействие цитотоксических Т-лимфоцитов, которое не подразумевало прямой контакт клеток и презентацию антигенов. В данном случае активация CTL происходит благодаря перекрестной презентации антигенов инфицированных гепатоцитов синусоидальными эндотелиальными клетками печени. Специфическая направленность цитотоксического воздействия именно на пораженные гепатоциты достигается благодаря тому, что CTL выбрасывают огромное количество TNF (фактор некроза опухоли), который запускает апоптоз непосредственно в инфицированных гепатоцитах, тогда как свободные от вируса клетки не затрагиваются. По такому не каноничному механизму протекает около 40% всех цитотоксических процессов, опосредованных CTL.
После рассмотрения механизмов запуска апоптоза хотелось бы немного обратиться и к самой клеточной смерти. Как любая смерть, гибель клеток может принимать различные формы. В менее философском смысле клеточная смерть может протекать регулируемо, либо наступает бесконтрольно. Регулируемая клеточная смерть вовлекает в данный процесс клеточный молекулярный аппарат, тогда как неконтролируемая гибель клетки может быть вызвана массивными физическими, химическими, механическими стимулами экзогенного происхождения. Вообще, изначально формы клеточной смерти различали по морфологическим признакам: например, для контролируемой гибели клетки характерна картина апоптоза — конденсация ДНК (пикноз), фрагментация ядра (кариорексис), отшнуровывание мембранных везикул и их поглощение фагоцитами; для неконтролируемой гибели клеток типична картина некроза — набухание клеток (онкоз), потеря целостности клетки и обнажение клеточного содержимого. Теперь же классификация форм клеточной смерти основывается по большей части на молекулярных параметрах, поскольку многие морфологические проявления различных механизмов сходны, а также возможен переход из одной формы клеточной смерти в другую.
Напоследок хотелось бы рассмотреть несколько сигнальных путей, ведущих к апоптозу инфицированных гепатоцитов. Катализируют данный процесс ферменты, относящиеся к семейству каспаз (Сysteinyl ASPartat-specific proteASE). Ферменты этого семейства представляют собой цистеиновые протеазы, разрезающие белки по остаткам аспартата. Они синтезируются изначально в виде проэнзимов, которые затем активируются. Прокаспазы могут быть активированы аутокаталитически после привлечения адапторных молекул, либо могут быть расщеплены другими каспазами и подвергнуться трансактивации. Таким образом, формируется целый каскад активации каспаз, в котором инициирующие каспазы активируются за счет рекрутинга адапторных молекул, а затем происходит трансактивация последующих эффекторных каспаз. При этом инициирующие каспазы (к ним относятся каспазы 8, 10 и 9) могут быть активированы за счет внешней стимуляции рецепторов смерти, либо за счет внутриклеточных сигналов, в передаче которых задействованы митохондрии.
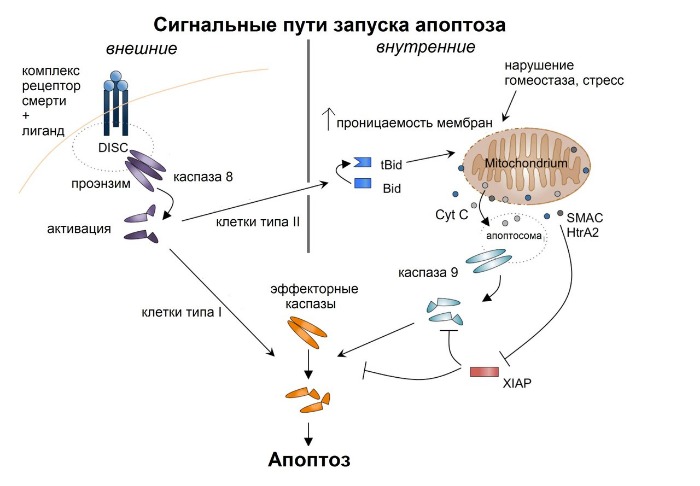
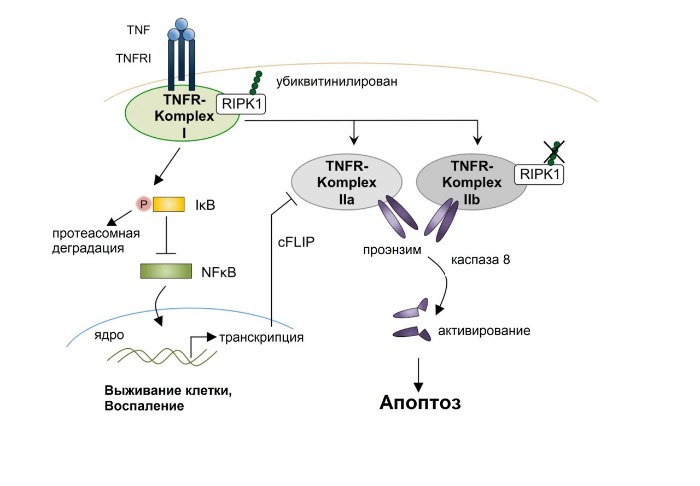
Внешние цитотоксические сигналы имеют своей целью активацию рецепторов смерти на поверхности клеток. Эти рецепторы относятся к суперсемейству рецепторов TNF и характеризуются наличием консервативных цитоплазматических белковых доменов (death domain, DD). Рецепторы TNF охватывают рецепторы Fas, TNFR1, TRAIL-рецептор 1/2, DR3. Лигандами для данных рецепторов служат цитокины из белкового семейства TNF (FasL, TNF, TWEAK, TL1A и TRAIL). После связывания лиганда тримеризованный цитоплазматический домен становится способным рекрутировать адапторные молекулы, содержащие подобные белковые домены — FADD (Fas associated DD) и TRADD (TNFR associated DD). Эти белки выполняют как бы роль фундамента для образования мультипротеинового рецепторного комплекса (данные комплексы различаются по составу в зависимости от типа клеток и типа рецептора смерти). Еще в проапоптотической форм рецептор привлекает инициирующие каспазы 8/10 посредством белковых доменов, называемых death effector domain, вследствие чего запускается аутокаталитическая активация. Следует также отметить, что в некоторых типах клеток, как, например, в Т-лимфоцитах, каспазы 8/10 могут напрямую активировать эффекторные каспазы (эти клетки объединены в тип I). Но есть и клетки, в которых внешний апоптотический сигнал усиливается с помощью внутриклеточных сигналов, и такие клетки относят к типу II (например, гепатоциты, бета-клетки островков Лангерганса ПЖ). Таким образом, внешний и внутренние клеточные сигналы о запуске апоптоза имеют одну цель и могут быть взаимосвязаны
Однако во внутриклеточных сигналах главная роль отводится уже не рецепторам смерти, а митохондриям. Именно в них происходит интеграция сигналов ото всех внутриклеточных компартментов. Если преобладают стрессовые сигналы (находятся под контролем белков семейства Bcl-2), то повышается проницаемость мембран митохондрий, вследствие чего из межмембранного пространства в цитоплазму поступают проапоптотические белки, среди которых цитохром С, SMAC и HtrA2, которые содействуют активации каспаз. Для этого цитохром С совместно с фактором активации апоптотической пептидазы (APAF-1) формирует при затрате АТФ гептамерный комплекс — апоптосому — который путем связывания и олигомеризации инициирующей каспазы 9 выполняет роль стартовой площадки для запуска каскада активации каспаз, поскольку активированная таким образом каспаза 9 может активировать эффекторные каспазы 3, 6 и 7. А вот SMAC и HtrA2, в отличие от цитохрома С, активируют каспазы не напрямую, а опосредованно через ингибирование белков семейства IAP (inbitor of apoptosis protein), некоторые из которых напрямую препятствуют активации каспаз, а другие оказывают влияние на «принятие решения» в сторону апоптоза или выживания клетки после поступления сигналов от рецептора смерти TNFR1.
Помимо внутриклеточных стрессовых сигналов, запуск апоптоза изнутри клетки может осуществляться по пути, опосредованным гранзимом В, который позволяет также усилить апоптотические сигналы, поступающие извне. Гранзим В, как и активированная вследствие стимуляции рецепторов смерти каспаза 8 способен расщеплять белок Bid (BH3 interacting domain death agonist, из семейства Bcl-2), тем самым вызывая повышение проницаемости мембран митохондрий. Предполагается, что данный процесс особенно важен в клетках типа II, описанных чуть выше, поскольку служит также для активации эффекторных каспаз. Вероятно, потребность в участии митохондрий в запуске апоптоза объясняется тем, что в клетках II типа каспазы ингибированы большим количеством белка из семейства IAP, и потому только с помощью выделяемых митохондриями SMAC и HtrA2 действие ингибиторов каспаз может быть предотвращено и становится возможным запуск каспазного каскада.
Подробнее о роли митохондрий в запуске апоптоза хотелось бы поговорить в отдельном посте.
Источники:
- Löffler Basiswissen Biochemie mit Pathobiochemie, Vol 6. Auflage (Springer), 2005
- Knolle, Thimme Hepatic Immune Regulation and Its Involvement in Viral Hepatitis Infection, Gastroenterology, 2014
- Galluzzi et al. Organelle-specific initiation of cell death, Nature cell biology, 2014
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Хронический гепатит С — Причины
Как передается гепатит С?
Хронический гепатит С передается несколькими путями:
- парентеральный, особенно транфузионный (переливание крови, ее компонентов — криопреципитата, фибриногена, факторов VIII и IX; парентеральное введение различных лекарств; гемодиализ); HCV является главной причиной посттранфузионного гепатита (85-95% всех случаев);
- половой путь;
- от матери плоду (через плаценту).
Гистологические проявления хронического гепатита С варьируют от ХПГ до ХАГ с циррозом или без цирроза печени. Распространение гепатита С во многом зависит от экологических факторов.
Существует 2 главных механизма повреждения печени вирусом гепатита С:
- прямое цитопатическое (цитотоксическое) действие вируса Сна гепатоциты;
- иммуноопосредованное повреждение печени, в пользу чего говорят данные о том, что вирусный гепатит С может ассоциироваться с аутоиммунными заболеваниями (синдром Шегрена, криоглобулинемия и др.), а также обнаружение в биоптатах печени больных вирусным гепатитом С лимфоидно-клеточной инфильтрации, состоящей из В- и Т-Лимфоцитов.
Маркеры вируса гепатита С обнаруживаются среди медицинского персонала гематологических отделений в 12.8%, у больных с заболеваниями крови — в 22.6%, у больных хроническим гепатитом — в 31.8%, у больных циррозом печени — в 35.1% случаев, среди населения России — у 1.5-5% жителей.
Иммунитет при гепатите С является не оптимальным (его называют субоптимальным), что не обеспечивает надежного контроля над инфекционным процессом. Поэтому острый вирусный гепатит С так часто трансформируется в хронический, этим же объясняется и частое реинфицирование вирусом С. Вирус гепатита С «ускользает» из-под иммунологического надзора. Объясняется это уникальной способностью вируса гепатита С постоянно изменять антигенную структуру, многократно обновляться в течение даже одной минуты. Такая постоянная изменчивость вируса гепатита С приводит к тому, что в течение суток появляется 1010-11 антигенных вариантов HCV, которые близки, но все-таки иммунологически различны. В такой ситуации система иммунитета не успевает непрерывно распознавать все новые и новые антигены и непрерывно продуцировать нейтрализующие их антитела. В структуре HCV максимальная изменчивость отмечается в антигенах оболочки, белок С сердцевины меняется мало.
Течение HCV-инфекции растягивается на многие годы (по типу медленной вирусной инфекции). Клинически выраженный хронический гепатит развивается в среднем через 14, цирроз печени — через 18, гепатокарцинома — через 23-18 лет.
Отличительная особенность острого вирусного гепатита С — торпидное, латентное или малосимптомное течение, обычно длительное время остающееся нераспознанным, вместе с тем постепенно прогрессирующее и в дальнейшем быстро приводящее к развитию цирроза печени с гепатоцеллюлярной карциномой (вирус гепатита С — «ласковый убийца»).
Маркерами фазы репликации вируса гепатита С являются обнаружение в крови анти-HCVcoreIgM и IgG с показателями коэффициента анти-HCVlgG/IgM в пределах 3-4 УЕ при отсутствии aHTH-HCVNS4 и обнаружения HCV-PHK в крови.
Вирус гепатита С может реплицироваться и внепеченочно, в том числе в моноцитах.
Механизмы повреждения печени при хроническом гепатите С
Считают, что вирус оказывает прямое цитопатическое действие. Это действие отличается от повреждения, вызываемого HBV, которое считают иммунным. Появляется всё больше данных о том, что в хронизации HCV-инфекции играют роль также иммунные механизмы.
Цитотоксические флавивирусы склонны обусловливать прямое гепатоцеллюлярное повреждение без выраженного воспаления. При хронической HCV-инфекции гистологическое исследование печени выявляет минимальное повреждение, несмотря на прогрессирование. Лимфоцитарная реакция выражена слабо, отмечается эозинофилия цитоплазмы гепатоцитов. В отличие от хронического гепатита В лечение хронической HCV-инфекции ИФН сопровождается быстрым снижением активности АлАТ и концентрации HCV-PHK.
Существует корреляция между тяжестью заболевания и уровнем виремии. Очень высокие уровни виремии и тяжёлое поражение печени наблюдаются у больных с хронической HCV-инфекцией после трансплантации печени.
Иммунный ответ на HCV слабый, что подтверждается повышением активности АлАТ, которое сопровождается увеличением титров HCV-PHK. При инокуляции значительного количества вирусных частиц (переливание крови) заболевание печени протекает тяжелее, чем при менее массивном попадании вирусов в организм (внутривенное введение наркотиков).
У носителей HCV отмечается персистирующая HCV-виремия без клинически очерченного заболевания печени. Корреляция между содержанием HCV-PHK в ткани печени и гистологической активностью отсутствует.
Иммунодепрессивная терапия снижает активность сывороточных трансаминаз, хотя виремия при этом нарастает.
Результаты иммуноэлектронной микроскопии дают основания полагать, что внутридольковые цитотоксические Т-клетки поддерживают поражение печени. Цитотоксические лимфоциты распознают эпитопы сердцевины и белковой оболочки HCV. Исследования in vitro аутологичной гепатоцитотоксичности убедительно показали, что HLA 1-рестриктивная СD8+-Т-клеточная токсичность является важным патогенетическим механизмом при хронической HCV-инфекции.
Серологические тесты на аутоантитела (антинуклеарные, к гладкой мускулатуре и ревматоидный фактор) положительны. Однако эти аутоантитела не влияют на тяжесть заболевания и не имеют патогенетического значения.
Получены доказательства печёночной цитотоксичности при хронической HCV-инфекции. Иммунный ответ на HCV также чётко документирован, однако остаётся неясной его роль как защитного фактора и как фактора, обусловливающего хроническую инфекцию.
Источник