Лекарство от вич создано учеными
Содержание статьи
В России синтезировали вещество, способное убить ВИЧ-инфекцию
Подпись: Вадим Макаров (справа) и Шон Экинз (Sean Ekins) – научные руководители российской и американской научных групп по разработке лекарства от ВИЧ
Жизнь полна парадоксов. Лекарство от болезни века, которое только в нашей стране ждут 1,5 миллиона пациентов, создается совместными усилиями русских и американских ученых. И это несмотря на похолодание в отношениях между Россией и США! Проект начался 3 года назад по инициативе Национального института здоровья США и Федерального исследовательского центра «Фундаментальные основы биотехнологии» РАН (ФИЦ Биотехнологии РАН) при поддержке Российского фонда фундаментальных исследований. Но за такой короткий срок ученым удалось не только сконструировать и получить чудодейственное вещество, но и экспериментально продемонстрировать его способность уничтожать ВИЧ в его «логове» — нейронах. О том, как идет работа по созданию оружия для борьбы с вирусом, который уже унес жизни десятков миллионов людей, рассказал Вадим Макаров, доктор фармацевтических наук, заведующий лабораторией биомедицинской химии ФИЦ Биотехнологии РАН.
Агрессивный новичок
— Вадим Альбертович, ВИЧ был обнаружен еще в конце прошлого века. Почему лекарство так сложно было создать? Чем этот вирус отличался от других?
— С точки зрения биологии этот вирус очень похож на многие другие. Единственное, его фатальное отличие от других вирусов – это поражение иммунной системы человека, именно поэтому организм не может с ним бороться самостоятельно.
— Это своего рода агрессивный новичок?
— Есть новички и агрессивнее. Если мы возьмем вирус геморрагической лихорадки Эбола, то с ней человек может жить всего несколько дней. Просто вирус Эбола не настолько распространился. Прогресс, который был достигнут в последние 10 лет в борьбе с ВИЧ, очень значителен. Пациенты, инфицированные этим вирусом, могут сейчас жить достаточно долго — десятки лет, поскольку появилось большое количество активных лекарственных препаратов, способных перевести заболевание из острой фазы в хроническую. Но проблема в том, что даже очень мощная антивирусная терапия не может полностью убрать вирус из организма. Она просто загоняет вирус в некое «депо», откуда его извлечь невозможно. Такими «депо» для вирусов ВИЧ являются нервные клетки — нейроны. Кстати, эта картина очень похожа на вирус герпеса. Он есть почти у всех людей, у кого-то проявляется, а у кого-то может годами “отсиживаться” в нейронах и ждать своего часа. Так вот, наша объединенная команда впервые создала вещество, которое будет способно уничтожить вирус ВИЧ во всем организме, включая нейроны. Не просто перевести заболевание в хроническую форму, а полностью излечить человека!
Мыши на вес золота
— Вы уже дошли до клинических испытаний?
— До клинических — нет, но лабораторных мышей мы уже успешно лечим.
— Зачем в этом проекте мы и американцы нужны друг другу?
— Во-первых, потому что работа с вирусом ВИЧ требует астрономических денежных ресурсов. Ни одна сторона не хотела брать на себя всю тяжесть потенциальных финансовых потерь, поскольку велик риск, что мы будем много работать, но в итоге не сможем создать препарат принципиально нового поколения. Во-вторых, это крайне сложная работа, ее невозможно было сделать только в России, у нас нет ни адекватных моделей на животных, ни биологических технологий для проведения тестов. Например, для экспериментов на животных надо использовать безумно дорогих мышей, которые есть только в США. В то же время, российская химическая школа является ведущей мировой школой в области тонкого химического синтеза. Мы были лидерами 100 лет назад, и надеюсь, останемся ими в будущем. Именно поэтому наших ученых и привлекли для участия в совместном проекте.
— Почему нужны безумно дорогие мыши? Нельзя было найти подешевле?
— А это особые мыши — гуманизированные. У них с помощью современных технологий создали иммунную систему, которая идентична человеческой, можно сказать, что это просто человеческая иммунная система. Такие мыши — очень удобный лабораторный объект, можно испытать препарат и понять, как он будет воздействовать на человека.
— Как с американцами делили зоны ответственности?
— Как я уже сказал, российская сторона отвечает за химическую составляющую, дизайн и синтез соединений. Американские коллеги занимаются биологической частью и компьютерным моделированием. Выглядело это так: сначала мы с американскими партнерами обсуждали идеи, затем их специалисты на суперкомпьютерах проверяли насколько наши предположения реалистичны. Так формировался некий список перспективных соединений. Синтез этих соединений осуществляется здесь в Москве, в ФИЦ Биотехнологии РАН. И в конечном итоге готовые соединение тестируются в США.
От лаборатории до аптеки дистанция 10 лет
— Когда готовое лекарство может появиться в аптеках?
— От лаборатории до аптеки очень длинная дистанция. При благоприятном раскладе понадобится минимум 10 лет. Быстрее невозможно. Это связано с определенной последовательностью экспериментов и необходимым количеством данных, которые надо накопить. А отчасти с тем, что человечество само себе создало огромное количество преград на пути появления новых лекарств. Пройти согласование во всех регулирующих инстанциях очень тяжело и очень дорого. И это не только у нас, это практика всех стран мира. Кроме того, через год наш совместный проект заканчивается и надо будет искать финансирование под практические работы. Многие фармкомпании и фонды не стремятся вступать в такие долгие и дорогостоящие проекты, именно поэтому и сегодня наши исследования финансируются государственными фондами как со стороны России, так и со стороны США. Разработка лекарства для борьбы с ВИЧ это скорее задача государства.
— В свое время много шума наделала история, так называемого «берлинского пациента» — Тимоти Брауна, он считается первым человеком, которого вылечили от ВИЧ. Ему трансплантировали стволовые клетки донора, имеющего иммунитет к ВИЧ. Такой метод лечения может быть массовым?
— Я с большой осторожностью отношусь к заявлениям, что кто-то от чего-то вылечился на единичном примере. Мы не знаем достоверно, вылечился он или нет, это не клинические испытания, которые делаются в соответствии с очень строгим протоколом и которым можно доверять. Вирус может затаиться в нейронах и проснуться, когда пройдет много времени. Мы в своей работе придерживаемся позиций доказательной медицины, когда есть слепые клинические испытания на большой выборке. Что касается стволовых клеток, то это вопрос неоднозначный. Безусловно, есть примеры, когда стволовые клетки работают успешно, но это не касается вируса ВИЧ. Поэтому мы исходим из традиционных подходов: с одной стороны, есть вирус, с другой стороны — надо найти вещество, которым этот вирус можно уничтожить.
— А откуда все-таки появился ВИЧ? Существуют самые разные теории, по одной из версий вирус — это побочный эффект разработок биологического оружия…
— Происхождение вируса не является областью моей компетенции, моя ответственность — это разработка вещества, способного убить вирус. На самом деле есть только одна серьезная научная версия происхождения ВИЧ. Вирус появился в процессе мутации в Африке. Сначала он возник у человекообразных приматов, потом был перенесен на человека. Все остальные версии: космические, Божественные, конспирологические, не имеют отношения к здравому смыслу и научным сообществом не рассматриваются. И это не последний случай появления неизвестных ранее смертельных инфекций. Мы считаем, что новые вирусы будут появляться по мере развития человека, а мы будем придумывать вещества для их уничтожения. Это бесконечный непрерывный процесс.
ЧИТАЙТЕ ТАКЖЕ
В Лондоне выздоровел пациент с ВИЧ: случайный успех или победа человечества над СПИДом?
Пациенту, у которого болезнь перешла в смертельно тяжелую стадию, пересадили костный мозг, и ВИЧ пропал из организма (подробности)
Источник
Зидовудин животворящий. Краткая история лечения ВИЧ — от смертельной эпидемии до исцеления
Как считается в наши дни, вспышка вируса иммунодефицита человека, приведшая к мировой эпидемии (то есть та исходная точка, от которой принято отсчитывать начало пандемии), имела место в Киншасе, ныне столице Демократической Республики Конго, а тогда — столице соответствующей бельгийской колонии. К началу 60-х годов инфекция распространилась практически по всей территории африканских стран южнее Сахары. Она воспользовалась построенными европейцами железными дорогами и транспортной сетью, связавшей основные населенные пункты с самыми отдаленными регионами континента.
К этому времени большинство государств «черной Африки» обретают независимость. Квалифицированный персонал бывших рабовладельческих колоний Нового Света, в том числе и Гаити, чье население и теперь состоит более чем на 90 % из потомков невольников, вывезенных европейцами на этот карибский остров с запада африканского континента, устремляется в молодые республики в качестве временной рабочей силы и к середине 60-х годов привозит вирус к берегам Соединенных Штатов.
Вместе с мигрантами и туристами вирус иммунодефицита попадает в Америку, где до конца 70-х, невидимый ни врачам, ни эпидемиологам, скрыто и бесконтрольно распространяется как среди гетеросексуального, так и среди гомосексуального населения. Но за счет особенностей его передачи к исходу десятилетия он поражает значительную часть именно гомосексуалов, и в начале 80-х оборачивается волной смертей его носителей. Организмы пациентов к этому моменту оказываются уже настолько поражены, что врачам приходится диагностировать у них состояние, в скором времени получившее название синдром приобретенного иммунодефицита — СПИД. А ученым — предпринимать немалые усилия, чтобы установить причину загадочной болезни, охватившей американских гомосексуалов.
К середине 1980-х исследователям удается обнаружить загадочного убийцу — это ВИЧ. Тогда же медики приступают к поискам лекарства от нового вируса. Как и в случае с пандемией нового коронавируса, чтобы сэкономить время и силы, а инфекция к тому моменту охватила уже все развитые страны, они пытаются в первую очередь приспособить для терапии уже существующие препараты. И первым из них оказывается Зидовудин, он же 3-азидо-3-дезокситимидин (азидотимидин, или сокращенно AZT).
Вместо рака
Само лекарство впервые синтезировал еще в 1964 году американский ученый Джером Хорвиц (Jerome Phillip Horwitz), изначально он предполагал использовать его в рамках химиотерапии для лечения опухолей (рака и саркомы). По идее создателей, AZT должен был работать как антиметаболит, нарушающий процесс биосинтеза ДНК раковых клеток. Как и другие антиметаболиты, в клетке азидотимидин должен был конкурировать с нормальными нуклеотидами, из которых обычно строятся нуклеиновые кислоты.
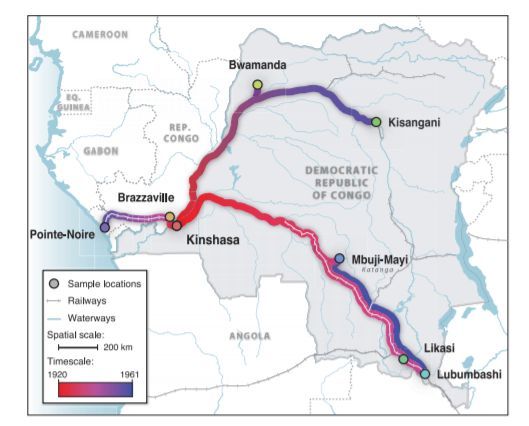 Территориальное распространение ВИЧ-1 группы М
Территориальное распространение ВИЧ-1 группы МЦвет кружков, которыми отмечены выбранные места, соответствует предполагаемому времени появления на данных территориях ВИЧ-1 группы М из Киншасы. Наиболее вероятные пути распространения вируса располагаются по транспортной сети ДРК (железные дороги, водные пути), которая функционировала до 1960 года. В левом нижнем углу представлен градиент, который отображает временную шкалу распространения вируса.
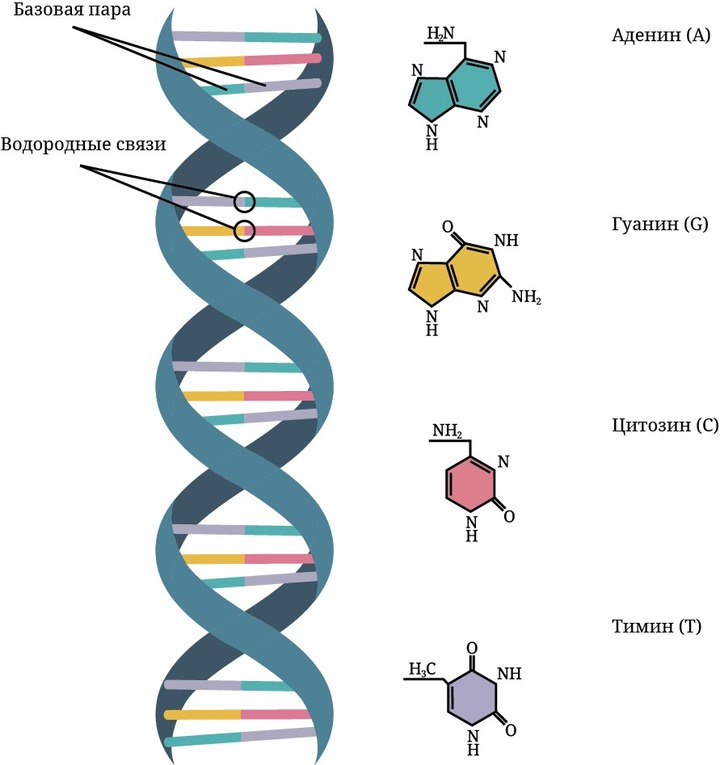
Каков тут принцип? Чтобы понять, придется немного поднапрячься: если вы вспомните, как обычно изображаются в школьных учебниках спирали нуклеиновых кислот, то заметите, что по плоскости спирали художники-иллюстраторы, как правило, изображают прямоугольные частицы четырех чередующихся между собой цветов. Это и есть те самые нуклеотиды — «кирпичики», из которых состоят ДНК и РНК. РНК состоит из сахара рибозы и азотистых оснований: гуанина, аденина, урацила и цитозина. ДНК — из другого моносахарида (дезоксирибозы) и азотистых оснований: гуанина, аденина, цитозина и тимина.
Тимидин — это нуклеозид, состоящий из сахара дезоксирибозы и азотистого основания тимина. Азидотимидин — его аналог, который при делении клетки может замещать правильный «кирпичик» в ДНК, делая клетку нежизнеспособной. Препараты такого типа удачно использовались в химиотерапии рака, поскольку включение антиметаболитов в нуклеиновые кислоты в клетках опухоли происходит интенсивнее, чем в нормальных клетках. Расчет врачей был на то, что, лишь слегка задевая здоровые клетки организма, лекарство, попав в него, будет мешать делиться именно раковым. Но с AZT такого не произошло.
Битые «кирпичики»
Препарат оказался слишком токсичным и недостаточно эффективным, так что его надолго отложили на полку за ненадобностью. Вирусы в процессе своего размножения, так же как и сами клетки, попав внутрь клеток, вынуждены копировать свою РНК. Они собирают ее из тех же «кирпичиков», что и клетка. Именно поэтому, чтобы помешать им размножаться в организме, можно использовать так называемые нуклеотидные и нуклеозидные аналоги («сломанные», «ложные», но очень похожие на правильные «кирпичики»). По тому же принципу, как абзацем выше мы описали борьбу с делением опухоли.
Почти тридцатилетнее развитие медицины привело к тому, что к 2014 году в мировом масштабе широкое применение АРВТ предотвратило порядка 7,8 миллиона смертей.
Поскольку тимидин входит в состав только ДНК, а ВИЧ, в отличие от многих вирусов, использует именно ДНК, а не РНК, чтобы копировать свои белки, было логично обратиться к испытанию именно его аналогов. Единственным из испытанных тогда учеными аналогов эффективным оказался именно AZT, так что в 1987 году именно Зидовудин стал первым антиретровирусным препаратом, допущенным к применению против ВИЧ-инфекции.
Какое-то время после этого казалось, что открытие медиков навсегда позволит избавиться от страшной болезни, унесшей к тому моменту уже десятки тысяч жизней. Американские геи, пережившие страшную волну смертей, обрушившихся на страну во второй половине 80-х, и сейчас с ужасом вспоминают, как многим из них почти каждую неделю приходилось ходить на похороны близких друзей и знакомых. Но не тут-то было. Оказалось, что вирус мутирует, легко приспосабливается к лечению, а его фермент, ответственный за копирование ДНК (он называется обратной транскриптазой), научается игнорировать неправильные «кирпичики» и через пару месяцев перестает включать их в ДНК.
По факту лекарство, хоть и стало мировой сенсацией, смогло лишь частично отсрочить для своих пациентов ужасный конец, а не вылечить их от заболевания или хотя бы парализовать вред, наносимый вирусом организму.
К 1988 году СПИД, то есть последняя, смертельная стадия ВИЧ-инфекции, в США поставили 80 000 жителей страны, более 45 000 из них умерли. Феномен, позволяющий вирусу достаточно быстро приспособиться к препарату за счет считанных мутаций, называется резистентностью. Уже в 1989 году ученые впервые описывают, как ВИЧ вырабатывает резистентность к AZT, и продолжают поиски эффективной терапии. Очень скоро к ним приходит мысль отказаться от монотерапии ВИЧ, то есть лечения инфекции одним препаратом, и перейти к их сочетанию. Благо, к началу 90-х помимо Зидовудина появляются и другие нуклеотидные и нуклеозидные аналоги.
Так, в 1988 году в университете Макгилла в США был синтезирован Ламивудин, аналог цитидина. В 1991 году начинается применение Диданозина, аналога аденозина, а в 1992 году — еще до его официального одобрения правительством — Ставудина. К этому моменту диагноз СПИД в США поставлен 200 000 человек, а число погибших превышает 130 000.
Путь к успеху
ВИЧ становится первой причиной смертности среди мужчин в возрасте 25—44 лет в Штатах. В 1993 году на международной конференции по СПИДу в Берлине представляют исследование, которое доказывает, что терапия только препаратами описанного выше класса (их называют нуклеозидными ингибиторами обратной транскриптазы (НИОТ) — по имени того фермента, которому они мешают работать) не имеет долгосрочных эффектов.
по теме

Общество
Эпидемия ВИЧ, эпизод I. «Скрытая угроза»
В то же время ученые приступают к последним стадиям испытания нового типа препаратов от ВИЧ — ингибиторов протеазы. Они действуют уже на другой фермент вируса. Дело в том, что белки ВИЧ в клетке синтезируются в виде длинных цепочек белков-предшественников. Эти цепочки похожи на одну большую ленту, в которую вклеены все будущие части вируса. Они неактивны. Фермент протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся, сразу после того как оказались разделены, активными и тут же формируются в готовую вирусную частицу.
Как оказалось, если прибавить препарат из этого класса к двум уже существующим лекарствам, работающим по принципу нуклеозидного аналога, вирус ВИЧ становится неспособен адаптироваться к такой терапии и прекращает размножаться в организме.
Таким образом, к 1996 году у ученых формируется представление о трехсоставной терапии ВИЧ-инфекции. До сих пор именно она остается основой большинства известных нам схем АРВТ: в них входят два препарата НИОТ и третье звено, отличное по своему действию от предыдущих. Так для антиретровирусной терапии начинается новая эра. Именно тогда, с 1997 года, ВИЧ становится контролируемой хронической инфекцией, а люди, должным образом получающие лечение, перестают умирать от СПИДа.
ВИЧ-инфекция впервые перестает быть главной причиной смертности людей в возрасте от 25 до 44 лет (уже к 1997 году количество смертей от СПИДа в США снизилось на 47 %). А целью врачей становится не просто продление жизни больного, а снижение до неопределяемого уровня его вирусной нагрузки и повышение качества жизни за счет применения все менее токсичных препаратов с незначительными побочными эффектами.
В это время появляются: первый тест на вирусную нагрузку у пациента (в наши дни его можно сделать в любом центре СПИД), препараты Вирамун (невирапин, первый ингибитор обратной транскриптазы, работающий не по принципу аналогов, подсовывая вирусу неправильные элементы для ДНК, а непосредственно воздействующий на фермент, парализуя его работу, впоследствии эти препараты получили название ННИОТ — ненуклеозидные ингибиторы), Криксиван (Индинавир), ингибитор протеазы Норвир (Ритонавир), Комбивир (зидовудин + ламивудин в одной таблетке) и Делавирдин (еще один ненуклеозидный ингибитор обратной транскриптазы ВИЧ).
С развитием резистентности ВИЧ к ингибиторам протеазы старшего поколения в 1998 году медицинские власти одобряют Эфавиренз — препарат, ввиду своей эффективности в качестве третьего звена применяемый в России до сих пор.
Один шаг до исцеления
Если раньше начало терапии врачи старались отложить на как можно более поздний срок, то теперь, когда препараты становятся менее токсичными, медики смягчают условия для ее старта. Так, протоколы по лечению ВИЧ уже на заре 2000-х рекомендуют начинать лечение при количестве клеток CD4 менее 500 на микролитр.
Тогда же появляется первый комбинированный бустированный ингибитор протеазы в одной таблетке — Калетра (лопинавир + ритонавир) — и тенофовир, а вернее тенофовира дизопроксил фумарат (TDF) — пролекарство, которое в организме действует иначе, чем его предшественники. Только после того как он достигает цели, TDF распадается до активного метаболита — тенофовира дифосфата, он уже и является аналогом естественного нуклеозида — аденозина, который фермент обратная транскриптаза будет «ошибочно» встраивать в цепочку нуклеиновых кислот.
Также к 2002—2003 годам проходят одобрение эмтрицитабин, фосампренавир, атазанавир, фузеон — первый ингибитор входа, а к 2004 году — комбинированный препарат тенофовир + эмтрицитабин (Трувада), которому суждено на долгие годы стать главным средством доконтактной профилактики передачи ВИЧ во всем мире. В 2006 году американские надзорные ведомства одобряют первый комбинированный препарат, содержащий всю трехчастную схему в одной таблетке, — Атриплу (эфавиренз + тенофовир + эмтрицитабин).
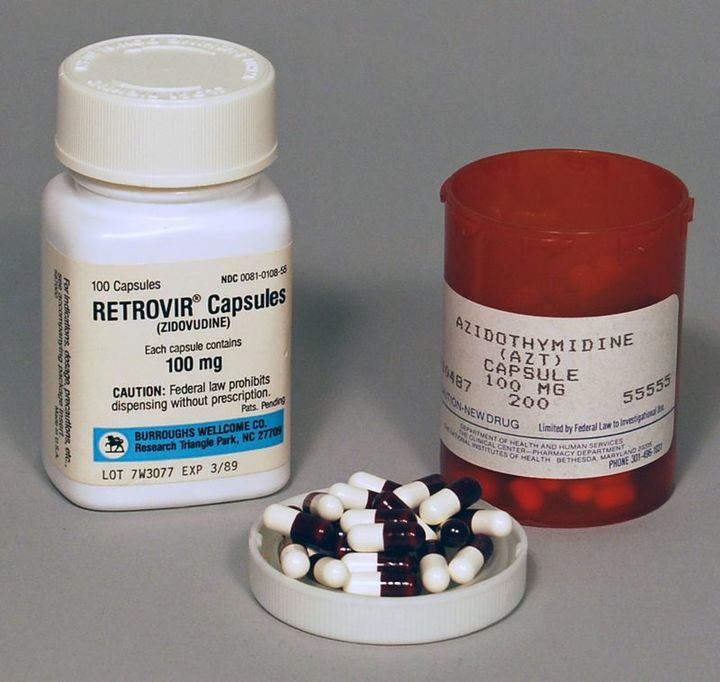 Так более тридцати лет назад выглядел главный препарат против ВИЧ-инфекции Зидовудин (AZT).
Так более тридцати лет назад выглядел главный препарат против ВИЧ-инфекции Зидовудин (AZT).С тех пор появились новые классы препаратов от ВИЧ, такие как ингибиторы интегразы (они парализуют деятельность фермента, который встраивает вирусную ДНК в человеческую), первым из них стал Исентресс (ралтегравир), ингибиторы проникновения вируса в клетку (Марвирок) и другие.
Уже в начале 2010-х на рынке оказываются такие эффективные и безопасные лекарства, как Тивикай (долутегравир), ученые приступают к разработке инъекционной терапии пролонгированного действия (ежедневный прием таблеток они должны заменить инъекционным введением лекарства раз в два месяца). Как разобраться во всех этих наименованиях? В ближайшие дни на нашем сайте появится новый раздел — энциклопедия АРВ-препаратов, лекарств, которыми лечится ВИЧ-инфекция. Там можно будет найти исчерпывающую информацию по каждому из них (раздел будет постоянно пополняться).
по теме

Общество
Таблетка от зомби-апокалипсиса: как ученые создают и испытывают лекарства?
А пока можно подвести некоторые итоги. Почти тридцатилетнее развитие медицины привело к тому, что к 2014 году в мировом масштабе широкое применение АРВТ предотвратило порядка 7,8 миллиона смертей. К 2015 году терапию удалось предоставить 15 миллионам человек по всему миру и значительно снизить число новых инфицирований — за счет того, что по достижении неопределяемой вирусной нагрузки вирус иммунодефицита не передается половым путем партнеру даже в случае незащищенного секса. Иногда достичь неопределяемой нагрузки можно буквально за несколько недель. Но непередающим человек становится только через 6 месяцев после первого анализа с неопределяемой нагрузкой.
Сейчас главной задачей медицины является уже не контроль над ВИЧ, а полная элиминация вируса в организме человека. Ранее «СПИД.ЦЕНТР» уже писал о нескольких случаях излечения от ВИЧ: двух берлинских пациентах, дюссельдорфском и лондонском. Случаи двоих последних были обнародованы всего год назад в Сиэтле на Конференции по ретровирусам и оппортунистическим инфекциям (CROI 2019). Они подверглись весьма небезопасной и сложной процедуре по пересадке стволовых клеток костного мозга, обычно назначаемой онкологическим больным.
В этом году на 23-й Международной конференции AIDS 2020 ученые рассказали о бразильском пациенте — впервые врачам не пришлось прибегать к опасной и неоднозначной процедуре, а результатов удалось достигнуть медикаментозно. Отчет об этой конференции можно прочитать по этой ссылке.
Источник