Нуклеозидные ингибиторы обратной транскриптазы вич
Содержание статьи
Как устроена антиретровирусная терапия?
Как работают АРВТ-препараты. Что такое ингибиторы обратной транскриптазы, интегразы, протеазы — и чем они отличаются друг от друга.
Вирусы довольно трудно «убить» в обычном понимании этого слова, потому что они обладают лишь немногими признаками живого, важнейший из которых — способность размножаться. За пределами организма вирусную частицу можно разрушить с помощью агрессивных химических веществ — дезинфицирующих средств или антисептиков. Но после того как вирус проник в организм, остается только один вариант — заблокировать его размножение. Именно на этом и основан принцип антиретровирусной терапии.
Почему?
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.
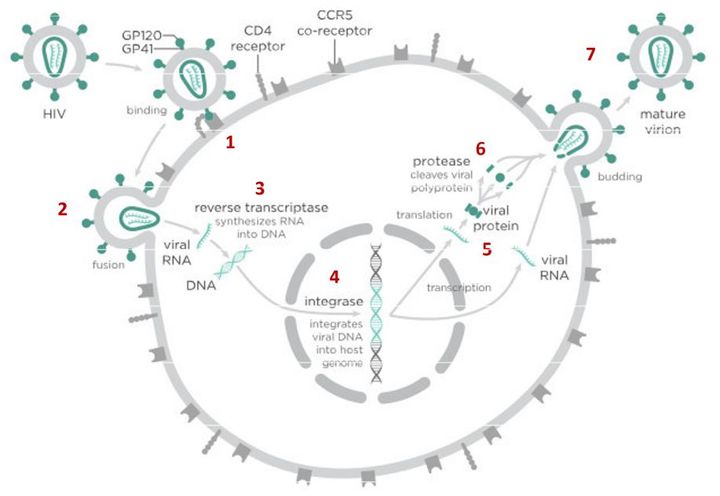
На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
Чтобы попасть внутрь, вирусной частице сначала необходимо «прилипнуть» к поверхности клетки. Для ВИЧ таким «клеем» является специальный белок gp120, который находится на поверхности вирусной частицы. Этот белок «приклеивается» к рецепторам CD4, расположенным на поверхности Т-лимфоцитов (Т-хелперов) и некоторых других клеток. Если у клетки нет рецептора CD4, то частица ВИЧ не может удержаться на ее поверхности и проникнуть внутрь, поэтому ВИЧ поражает только определенные типы клеток, имеющие этот рецептор. Например, некоторые Т-лимфоциты.
На этом самом первом этапе инфицирования клетки заблокировать процесс может ибализумаб — недавно зарегистрированный в США новый препарат против ВИЧ. Ибализумаб связывается с рецептором CD4 и мешает нормальному взаимодействию вирусного белка gp120 с ним. Из-за этого вирус не «прилипает» к клеткам-мишеням и не может в них проникнуть.
После «прилипания» к рецептору CD4 клетки-хозяина вирусная частица взаимодействует еще с одним рецептором — CCR5 (или с CXCR4 — в зависимости от типа вируса), чтобы лучше закрепиться на поверхности клетки.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.
Однако у ВИЧ все гены хранятся не в ДНК, как у людей, а в РНК. Поэтому вирус с помощью специального фермента — обратной транскриптазы — сначала должен переписать свои гены из собственной РНК в понятную нашим клеткам ДНК. Обратная транскриптаза работает как конвейер: захватывает отдельные нуклеозиды — строительные «кирпичики», из которых складывается ДНК, — и собирает их в готовую цепочку. А нужная (для воспроизводства вируса) последовательность кирпичиков-нуклеозидов при этом записана в исходной вирусной РНК.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
Разница между НИОТ и ННИОТ заключается в структуре молекул лекарств. Вещества первой группы по структуре похожи на нуклеозиды — те самые кирпичики, из которых строятся молекулы ДНК и РНК. Когда такой «неправильный кирпичик» попадает в «конвейер» обратной транскриптазы вируса, ее механизм «заклинивает», и она больше не может собирать вирусную ДНК. ННИОТ имеют другую структуру, непохожую на нормальные нуклеозиды, и блокируют обратную транскриптазу, связываясь с ее молекулой в других точках.
С этой особенностью строения связано и большее число побочных эффектов при приеме НИОТ по сравнению с ННИОТ: молекулы первого класса ингибиторов могут нарушать процессы синтеза РНК и ДНК и в наших собственных клетках, так как они похожи на «нормальные» нуклеозиды и тоже «заклинивают» наши собственные ферменты, но в гораздо меньшей степени, чем вирусные. НИОТ исторически были первым классом препаратов, которые начали использовать для лечения ВИЧ-инфекции.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Источник
Ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ)
Действие ННИОТ, как и НИОТ, направлено на обратную транскриптазу ВИЧ. Первые сообщения о ННИОТ относятся к 1990 году. В отличие от НИОТ, средства этой группы не выступают в качестве подложного строительного материала, а напрямую неконкурентно связываются с обратной транскриптазой в непосредственной близости от участка присоединения к ней нуклеозидов. Образовавшийся комплекс блокирует участок связывания обратной транскриптазы, в результате фермент связывается с меньшим числом нуклеозидов, и процесс полимеризации существенно замедляется. В отличие от НИОТ, ННИОТ не нуждаются во внутриклеточной активации.
Три имеющихся на сегодня ННИОТ — невирапин, делавирдин и эфавиренз — появились в 1996- 1998 годах. Хотя такие исследования, как INCAS и клиническое испытание по протоколу 0021II ясно продемонстрировали, что схемы из трех препаратов, одним из которых является невирапин или делавирдин, гораздо эффективнее схем их двух НИОТ (Gallant, 1998; Raboud, 1999; Conway, 2000), «взлет» ННИОТ прошел почти незаметно и, в отличие от ИП, внимания прессы эта группа антиретровирусных средств не привлекла.
Столь прохладное отношение к ННИОТ можно объяснить тем, что по данным первых наблюдений, функциональная монотерапия ННИОТ (то есть добавление ННИОТ к неэффективной схеме терапии) была фактически безрезультатной (Mayers, 1998; D’Aquila, 1996). Кроме того, с самого начала серьезные трудности вызывала устойчивость к ННИОТ. Риск перекрестной лекарственной устойчивости на фоне приема ННИОТ очень высок, и развиться она может очень быстро — одной точечной мутации в положении 103 (K103N) гидрофобного участка связывания достаточно, чтобы исключить из арсенала терапии целую группу антиретровирусных средств! Сегодня описаны случаи лекарственной устойчивости даже у женщин, принимавших невирапин однократно во время родов с целью профилактики передачи ВИЧ ребенку (Eshleman, 2002). И это не редкость. По данным двух крупных исследований, частота мутаций устойчивости к ННИОТ после перинатальной профилактики невирапином достигает от 14 до 32% (Cunningham, 2002; Jourdain, 2004). Недавние исследования с применением ПЦР в режиме реального времени показали, что мутации устойчивости обнаруживаются в 89 % образцов.
Таким образом, очень важно навсегда запомнить, что схемы, в которые входят ННИОТ, весьма уязвимы, и при недостаточно подавленной вирусной нагрузке промедление с заменой препарата почти наверняка приведет к устойчивости ко всем ННИОТ. Отмена же ННИОТ не сопровождается никакими иммунологическими или вирусологическими изменениями (Picketty, 2004). Объясняется это тем, что мутации устойчивости к ННИОТ не сокращают способность ВИЧ к репродукции настолько, насколько мутации устойчивости к ИП или НИОТ.
И рандомизированные, и крупные когортные исследования неоднократно подтверждали, что ННИОТ в сочетании с двумя НИОТ чрезвычайно эффективны. По способности восстанавливать иммунную систему и подавлять вирусную нагрузку у нелеченных пациентов ННИОТ по крайней мере не уступают ИП (Staszewski, 1999; Friedl, 2001; Torre, 2001; Podzamczer, 2002; Robbins, 2003; Squires, 2003). В то же время клиническая эффективность ННИОТ, в отличие от ИП, не доказана, поскольку в предлицензионных испытаниях ННИОТ всегда использовались только косвенные показатели. У леченных пациентов, судя по всему, ННИОТ менее эффективны, чем ИП (Yazdanpanah, 2004).
Тем не менее, простой режим приема и в целом хорошая переносимость позволили невирапину и эфавирензу занять видное место в схемах ВААРТ — их применяют даже чаще, чем ИП. Во многих рандомизированных исследованиях последних лет удалось показать, что при уже достигнутом хорошем вирусологическом эффекте ИП в схеме ВААРТ можно безболезненно заменить на ННИОТ. Более того, сдерживать вирусную нагрузку при переходе на ННИОТ иногда получалось даже лучше, чем при продолжении лечения прежней схемой с ИП (см. также гл. об изменении схемы ВААРТ).
Тогда как делавирдин по ряду причин (см. ниже) свои позиции утратил, эфавиренз и невирапин почти равнозначны. Пока ни одно исследование не смогло показать превосходство одного из них над другим. Когортные исследования нескольких последних лет указывают на некоторое преимущество эфавиренза (Phillips, 2001; Cozzi-Lepri, 2002); но ценность их результатов невелика, поскольку проводились они в слишком разнородных группах пациентов. Как бы то ни было, можно смело сказать, что разница между эфавирензом и невирапином — особенно для нелеченных больных — в целом незначительна. По крайней мере, проведенное в Испании пилотное рандомизированное клиническое испытание SENC в данной популяции больных существенных различий между этими препаратами не выявило (Nunez, 2002).
Исследование 2NN («Двойное исследование ННИОТ») стало первым крупным рандомизированном клиническим испытанием, посвященным сопоставлению невирапина с эфавирензом (Van Leth, 2004). В общей сложности в нем участвовали 1216 пациентов, которые получали базовую комбинацию НИОТ ставудин + ламивудин и либо невирапин по 400 мг 1 раз в сутки, либо невирапин по 200 мг 2 раза в сутки, либо эфавиренз по 600 мг 1 раз в сутки, либо эфавиренз по 800 мг 1 раз в сутки + невирапин по 400 мг 1 раз в сутки. Через 48 недель лечения в указанных группах вирусная нагрузка менее 50 мл-1 наблюдалась у 56 %, 56 %, 62 % и 47 % пациентов соответственно. Единственным значимым различием в вирусологической эффективности оказалось, таким образом, преимущество эфавиренза над комбинацией двух ННИОТ, которое в основном объяснялось более высокой токсичностью последней схемы. В группе получавших невирапин по 400 мг 1 раз в сутки тяжелое побочное действие на печень встречалось чаще, чем в группе получавших эфавиренз. С другой стороны, у пациентов, получавших невирапин без эфавиренза, не так драматично изменялись уровни липопротеидов крови. Таким образом, исследование 2NN, как и многие другие клинические испытания с заменой препаратов (Fisac, 2002; Martinez, 2003), показало, что выбирать между эфавирензом или невирапином прежде всего следует на основании различий в спектре их побочного действия (см. ниже).
Метаболизм эфавиренза и невирапина осуществляется изоферментами цитохрома P450 (Miller, 1997). Невирапин их активирует, а эфавиренз как активирует, так и подавляет. Сочетание эфавиренза с саквинавиром либо лопинавиром чревато выраженными лекарственными взаимодействиями, что требует крайне аккуратно подходить к подбору доз этих препаратов.
Источник
Антиретровирусная терапия online
Нуклеозидные ингибиторы обратной транскриптазы (НИОТ)
К классу НИОТ относился самый первый антиретровирусный препарат, одобренный для лечения ВИЧ-инфекции. Механизм действия этого класса препаратов основан на конкурентном подавлении обратной транскриптазы — фермента ВИЧ, который обеспечивает создание ДНК, на основе РНК вируса. Большинство этих препаратов являются аналогами нуклеозидов, отличаясь от них лишь небольшим изменением в молекуле рибозы. Встраивание их в синтезирующуюся цепь ДНК приводит к прекращению её синтеза из-за неспособности этого соединения образовывать фосфодиэфирную связь.
Абакавир
Абакавир
МНН: Абакавир (Abacavir, ABC)
Торговая марка / производитель:
Зиаген (GlaxoSmithKline)
Абакавир-АВС (Технология лекарств, Россия)
Олитид (Фармасинтез, Россия)
Абакавир Канон (Канонфарма продакшн, Россия)
Диданозин
 Диданозин
Диданозин
МНН: Диданозин (Didanosine, ddI)
Торговая марка / производитель:
Видекс (Bristol-Myers Squibb)
Диданозин (Aurobindo Pharma, Индия)
Зидовудин
 Зидовудин
Зидовудин
МНН: Зидовудин (Zidovudine, AZT, ZDV)
Торговая марка / производитель:
Азидотимидин (Биофарма, Россия)
Азимитем (Фармасинтез, Россия)
Виро-Зет (Ranbaxy, Индия)
Зидовирин (Верофарм, Россия)
Зидовудин (Aurobindo Pharma, Индия)
Зидовудин (ФП Оболенское, Россия)
Зидовудин-АЗТ (Технология лекарств, Россия)
Зидовудин-Ферейн (Брынцалов-А, Россия)
Ламивудин
 Ламивудин
Ламивудин
МНН: Ламивудин (Lamivudine, 3TC)
Торговая марка / производитель:
Амивирен (Фармсинтез, Россия)
Виролам (Ranbaxy, Индия)
Гептавир-150 (Hetero Drugs, Индия)
Зеффикс (GlaxoSmithKline)
Ламивудин (Aurobindo Pharma, Индия)
Ламивудин-3ТС (Технология лекарств, Россия)
Ламивудин-Виал (Виал, Россия)
Эпивир (GlaxoSmithKline)
Эпивир ТриТиСи (GlaxoSmithKline)
Ламивудин-Тева (Teva)
Ставудин
 Ставудин
Ставудин
МНН: Ставудин (Stavudine, d4T)
Торговая марка / производитель:
Актастав (Actavis, Исландия, производство — Emcure Pharmaceuticals, Индия)
Веро-Ставудин (Верофарм, Россия)
Вудистав (Ranbaxy, Индия)
Зерит (Bristol-Myers Squibb)
Ставудин (Aurobindo Pharma, Индия)
Ставудин (Фармсинтез, Россия)
Ставудин (ФП Оболенское, Россия)
Стаг (Макиз-Фарма, производство — Hetero Drugs)
Тенофовир
Тенофовир
МНН: Тенофовир (Tenofovir, TDF или PMPA)
Торговая марка / производитель:
Виреад (Gilead Sciences)
Тенофовир (Hetero Drugs, Индия)
Тенофовир (Фармасинтез, Россия)
Тенофовир-ТЛ (Технология лекарств, Россия)
Тенофлек (Нанолек, Россия)
Тенофовир ВМ (ИИХР, Россия)
Тенвир (Cipla, Индия — зарегистрировано в Украние)
Фосфазид
 Никавир
Никавир
МНН: Фосфазид (Phosphazide)
Торговая марка / производитель:
Никавир («АЗТ ФАРМА К.Б.», Россия)
Эмтрицитабин
 Эмтрицитабин
Эмтрицитабин
МНН: Эмтрицитабин* (Emtricitabine, FTC).
Торговая марка / производитель:
Эмтрицитабин / производство — Jiangsu Tasly Diyi Pharmaceutical Co., Ltd (Китай)/упаковка — Биокад (Россия);
Эмтритаб (Фармсинтез, Россия)
Emtriva (Gilead Sciences Inc.) — не зарегистрирован в РФ.
Источник