Склонность к мутации у вич выражена
Содержание статьи
«Мы следим за ВИЧ. И мы видим, насколько быстро он мутирует»
ВИЧ обладает огромной вариабельностью генома – способностью очень быстро мутировать – намного быстрее, чем, например, вирус гриппа. Именно поэтому с ВИЧ так сложно бороться: разработка вакцин и эффективной терапии упирается в то, что вирус опережает ученых.
Для решения этих задач необходимо, прежде всего, знать, с кем мы имеем дело – то есть знать обо всем разнообразии вируса, и о том, как он меняется.
Это важно понимать и для целей практической медицины: если, например, появилась новая группа, подтип или вариант ВИЧ, необходимы диагностические системы, которые могут их определять.
О том, как происходит изучение мутаций ВИЧ, его эволюции и о новых диагностических системах, которые позволяют улавливать малейшие изменения в геноме вируса, рассказал вице-президент отдела прикладных исследований и технологий компании Abbott доктор Джон Хэкет (John Hacket). Кстати, Abbott была первой компаний, создавшей в 1985 году тест на определение антител к ВИЧ, то есть тест, позволявший диагностировать вирус в крови.
Быстрее гриппа
В настоящее время известно о существовании двух типов — ВИЧ 1 и ВИЧ 2. ВИЧ 1 является наиболее распространенным типом и делится на группы – М (эта группа самая распространенная), N,O и P. Группа Р была обнаружена совсем недавно – в 2009 году у женщины из Камеруна, которая приехала во Францию. В группе М существует еще и множество подтипов. При этом постоянно происходит образование новых вариантов. Не исключено, что скоро возникнут новые группы и подтипы вируса.
«ВИЧ мутирует чрезвычайно быстро. Намного быстрее, чем вирус гриппа. Например, за 5-6 лет у одного человека с ВИЧ разнообразие вируса становится сопоставимым с разнообразием вируса гриппа среди всего человечества в мире», — говорит Джон Хэкет.
Такая скорость мутации происходит по нескольким причинам. Во-первых, когда ВИЧ копирует себя, появляются «ошибки» или мутации в его генетической последовательности, что увеличивает его разнообразие.
Во-вторых, ВИЧ реплицируется (размножается) необыкновенно быстро: в больном, который не получает лечение, образуется до десяти миллиардов вирусных частиц в день.
В-третьих, вирус обладает способностью к рекомбинации: например, если человек инфицирован разными суб-типами ВИЧ, они рекомбинируют между собой в организме человека, что и приводит к образованию нового варианта вируса.
«Важно не пропустить новые формы»
Когда медикам и ученым стало понятно, что разнообразие ВИЧ столь велико, появилась необходимость в создании диагностических систем, которые могли бы не только определять все типы, группы и подтипы, известные на данный момент, но и выявлять новые. Ведь иначе можно получить ложноотрицательный результат, пропустив в образце варианты вируса, которых диагностическая система просто не знает.
«Перед тем как донорская кровь используется, она проверяется на наличие инфекционных заболеваний. С помощью оборудования Abbott проводится скрининг 60% донорской крови в мире», — говорит Джон Хэкет.
Он добавляет, что компания очень серьезно подходит к выполнению своего обязательства – обеспечить безопасное переливание крови, поэтому 20 лет назад была создана «Международная программа Abbott по наблюдению и выявлению новых мутаций ВИЧ и гепатита В».
«Крайне важно, чтобы наши тесты могли достоверно определить все существующие мутации ВИЧ и гепатита», – подчеркивает Хэкет.
На данный момент в рамках программы уже собрано более 25 тысяч образцов ВИЧ и гепатита В из 16-ти стран. Особое внимание удаляется очагам в Африке – поскольку именно там наблюдается максимальное разнообразие вариантов ВИЧ. В программе участвовали также 10 медицинских центров из России.
Для обнаружения новых вариантов ВИЧ используются самые современные научные методы, такие как секвенирование генома, включая глубокое секвенирование.
Для таких работ совместно с Калифорнийским университетом в Сан-Франциско (UCSF) был создан «Центр диагностики и исследований в области вирусологии UCSF-Abbott». Помимо изучения ВИЧ, там занимаются и поиском новых вирусов.
«Недавно ученые из этого центра обнаружили совершенно новый человеческий вирус. Он получил название Human pegivirus 2 (HPgV-2). Сейчас уже известно, что он передается через кровь и связан с вирусом гепатита С. Нам удалось определить восемь полных геномов и четыре неполных генома этого вируса. Нашим следующим шагом станет определение того, способен ли новый вирус вызывать заболевание, и если да, продолжать работу с учреждениями службы крови, чтобы обеспечить защиту донорской крови от этих типов новых вирусов», – говорит Хэкет.
Источник
Устойчивые к ВИЧ
Практически с самого начала эпидемии ВИЧ были отмечены редкие случаи, когда человек оказывался полностью устойчивым к вирусу, либо носительство вируса у него не переходило в стадию СПИДа. Егор Воронин в своем обзоре дает объяснение данному феномену.
Об авторе
Воронин Егор Анатольевич — доктор философии (PhD) по биологии, старший научный сотрудник Международной компании по созданию вакцины против ВИЧ (Global HIV Vaccine Enterprise, Нью-Йорк, США). Автор и соавтор 18 научных работ.
Ход болезни у конкретного человека определяется рядом факторов: общим состоянием организма и перенесенными ранее заболеваниями, разновидностью попавшего в организм микроорганизма, особенностями генотипа больного, наличием сопутствующих инфекций и т. п. Любое инфекционное заболевание у разных людей протекает по-разному. Для большинства болезней статистика типичных симптомов и сроков их протекания не включает в себя случаи, когда заболевание прошло «мягко» или вообще бессимптомно. И хотя такие ситуации обычно выпадают из поля зрения медиков, именно они представляют особый интерес, потому что могут указать на неизвестные механизмы защиты от инфекций. В этом смысле не является исключением и ВИЧ-инфекция, которая на сегодня считается неизлечимым заболеванием.
Практически с самого начала эпидемии ВИЧ были отмечены редкие случаи, когда человек оказывался полностью устойчивым к вирусу либо носительство вируса у него не переходило в стадию СПИДа. Исследования показали, что «виноват» в этом поверхностный лимфоцитарный белок CCR5, а точнее, его отсутствие у некоторых людей.
Дело в том, что когда вирус ВИЧ попадает в организм, он стремится проникнуть в лимфоциты — важнейшие иммунные клетки крови, участвующие в защите организма от инфекций. Чтобы суметь проникнуть в лимфоцит, белок оболочки на поверхности вируса должен связаться с двумя клеточными белковыми рецепторами на поверхности лимфоцитов, одним из которых и является белок CCR5 (Deng et al., 1996). Оказалось, что некоторые люди являются носителями мутации, которая предотвращает синтез СCR5, и, соответственно, их лимфоциты оказываются устойчивыми к заражению большинством вариантов ВИЧ.
 Тимоти Рэй Браун (в центре) — первый и единственный на сегодня человек, исцеленный от СПИДа. Для лечения острого лейкоза ему по случайности был пересажен костный мозг от донора, имевшего мутацию белка ССR5, которая дает устойчивость к ВИЧ. Фото с flickr.com
Тимоти Рэй Браун (в центре) — первый и единственный на сегодня человек, исцеленный от СПИДа. Для лечения острого лейкоза ему по случайности был пересажен костный мозг от донора, имевшего мутацию белка ССR5, которая дает устойчивость к ВИЧ. Фото с flickr.com
Могут существовать и другие механизмы невосприимчивости к ВИЧ, о которых мы просто не знаем. Так, коллектив французских ученых, работавший с группой из 1700 ВИЧ-инфицированных людей, недавно опубликовал результаты исследования двух необычных случаев устойчивости к инфекции, которые не были связаны с отсутствием белка СCR5 (Colson et al., 2014). В первом случае диагноз пациенту был поставлен еще в 1985 г., однако, хотя он и не принимал никаких антивирусных препаратов, стандартные анализы указали на полное избавление от вируса. Ни в крови, ни в культуре клеток крови этого человека не были обнаружены следы присутствия «живого» вируса.
Конечно, в первую очередь возник вопрос — а был ли пациент действительно инфицирован, или исследователи столкнулись с редкой диагностической ошибкой? Однако дополнительные анализы показали, что факт заражения имел место: в его крови были обнаружены антитела к ВИЧ и отдельные фрагменты вирусных белков, а также ничтожные количества вирусной ДНК, которую удалось определить лишь с использованием высокочувствительных методов.
Исследователи попытались заразить лимфоциты, взятые от этого пациента, «лабораторным» вариантом ВИЧ. Однако эта попытка не удалась, в отличие от контрольных лимфоцитов, взятых у других пациентов. В этот раз исследователи точно установили, что на лимфоцитах необычного пациента белок CCR5 присутствует, и поняли, что они имеют дело с новым механизмом блокировки репликации генома ВИЧ.
Возможный ключ к объяснению этого феномена был найден в тех небольших количествах вирусной ДНК, которые все же удалось выделить из крови пациента. Анализ их нуклеотидной последовательности показал, что этот вирусный геном просто напичкан мутациями. Мутированными оказалось около четверти кодонов*, кодирующих аминокислоту триптофан, которые в результате превратились в стоп-кодоны, останавливающие синтез белка.
Собственно говоря, механизмы иммунной защиты, которые могли таким образом инактивировать вирус, уже известны. ВИЧ относится к вирусам с РНК-геномом, и чтобы размножиться, он должен пройти стадию обратной транскрипции, т. е. РНК должна превратиться в ДНК. «Перехватить» вирусный геном на этой стадии может группа клеточных белков из семейства APOBEC3G. Они «отрывают» аминогруппу (–NH2) от цитозиновых нуклеотидов, превращая их в урациловые. В результате в геноме вместо комплементарных пар нуклеотидов «цитозин — гуанин» появляются пары «урацил — аденин». А поскольку в кодон триптофана входят два гуанина, их замена на аденин превращает триптофановый кодон в стоп-кодон (Sheehy et al., 2002).
Обычно ВИЧ удается обойти этот уровень защиты: у него имеется специальный белок, который атакует и уничтожает APOBEC3G. Но почему-то на сей раз этого не случилось, и весь жизнеспособный вирус оказался мутирован до состояния полной потери функциональности.
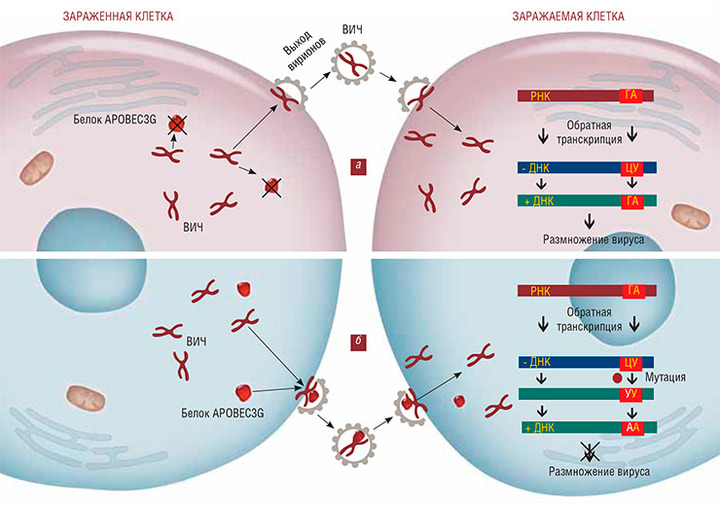 У обычного человека при заражении ВИЧ РНК-геном вируса успешно проходит стадию обратной транскрипции, в результате чего в клетке появляются полноценные копии вирусной ДНК (а). В случае вирусной невосприимчивости клеточные белки APOBEC3G, присоединяясь к вирусу, вызывают мутацию в его геноме в процессе обратной транкрипции. Мутированный ВИЧ теряет способность синтезировать необходимые ему белки и не может размножаться (б). По: palfir.com
У обычного человека при заражении ВИЧ РНК-геном вируса успешно проходит стадию обратной транскрипции, в результате чего в клетке появляются полноценные копии вирусной ДНК (а). В случае вирусной невосприимчивости клеточные белки APOBEC3G, присоединяясь к вирусу, вызывают мутацию в его геноме в процессе обратной транкрипции. Мутированный ВИЧ теряет способность синтезировать необходимые ему белки и не может размножаться (б). По: palfir.com
Предположив, что этот случай может быть не единичным, исследователи стали искать среди своих полутора тысяч пациентов со схожим анамнезом. И нашли! У этого человека также не удалось стандартными методами обнаружить ДНК- или РНК-вирусы. В крошечных фрагментах вирусной ДНК, которые удалось обнаружить у него в крови, также присутствовало большое число мутаций, схожих с теми, которые были найдены в первом случае. Однако лимфоциты второго пациента оказались неустойчивы к заражению «лабораторным» вариантом ВИЧ, поэтому не исключено, что механизм устойчивости к вирусу у него иной.
Многообещающим направлением этой работы является дальнейшее исследование механизмов устойчивости лимфоцитов первого пациента в экспериментах по заражению «лабораторным» штаммом вируса. Предполагается, что у этого человека имеется редкий вариант гена APOBEC3G, который ВИЧ не способен обойти. Но хотя это и было бы интересной находкой, такое открытие, скорее всего, не будет иметь широкого практического применения, поскольку пользу от такой мутации могут получить только ее носители. Тем не менее остается надежда на то, что при исследовании обнаружатся какие-то неизвестные ранее иммунные механизмы защиты, что даст толчок к разработке новых лекарств или методов предотвращения инфекции ВИЧ.
Авторы этой работы выдвинули также гипотезу, что в защите клеток от повторного заражения ВИЧ свою роль могут играть «фрагменты» вируса в виде коротких белков, образующиеся в результате досрочной остановки белкового синтеза на новых стоп-кодонах. Эти белки могут осуществлять защитную функцию либо, например, конкурируя с какими-то необходимыми для вируса белками, либо каким-то особым образом стимулируя иммунитет. Высказано даже предположение, что наблюдаемое явление формирования вирусной устойчивости — это естественный процесс эндогенизации ВИЧ, т. е. эволюционный процесс, в результате которого вирусная нуклеиновая кислота становится частью генома другого вида (в данном случае — человека).
Это предположение не так уж и фантастично: наши геномы полны «следов» древних инфекций — заражений ретровирусами, которые умеют встраивать свой наследственный материал в нашу ДНК. Ведь если в геном носителя встраивается не патогенный, а инактивированный вирус, который к тому же дает защиту против повторной инфекции, то он имеет намного большие шансы распространиться в популяции. И если начать масштабный поиск людей, которые несут вирус с большим количеством инактивирующих мутаций, то у нас появится шанс наблюдать эндогенизацию ВИЧ в реальном времени.
Источник
Как устроены ВИЧ и АРВТ? Объясняем на пальцах
Мы каждый день рассказываем о вирусе иммунодефицита человека, антиретровирусной терапии, последних медицинских исследованиях и жизни людей с ВИЧ. Но при этом на русском языке практически нет доступных объяснений, как устроен сам вирус ВИЧ и как работают таблетки. Есть только зубодробительная медицинская литература и невнятные описания, из которых совершенно ничего нельзя понять. Мы исправляем этот недостаток и объясняем буквально на пальцах, как это все устроено.
Вирусы довольно трудно «убить» в обычном понимании этого слова, потому что они обладают лишь немногими признаками живого, важнейший из которых — способность размножаться. За пределами организма вирусную частицу можно разрушить с помощью агрессивных химических веществ — дезинфицирующих средств или антисептиков. Но после того как вирус проник в организм, остается только один вариант «убить» его — заблокировать размножение.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

На первом этапе (цифра 1 на схеме) вирус проникает в клетку. Чтобы попасть внутрь, вирусной частице сначала необходимо «прилипнуть» к поверхности клетки. Для ВИЧ таким «клеем» является специальный белок gp120, который находится на поверхности вирусной частицы. Этот белок «приклеивается» к рецепторам CD4, расположенным на поверхности Т-лимфоцитов (Т-хелперов) и некоторых других клеток. Если у клетки нет рецептора CD4, то частица ВИЧ не может удержаться на ее поверхности и проникнуть внутрь, поэтому ВИЧ поражает только определенные типы клеток, имеющие этот рецептор. Например, некоторые Т-лимфоциты.
На этом самом первом этапе инфицирования клетки заблокировать процесс может ибализумаб — недавно зарегистрированный в США новый препарат против ВИЧ. Ибализумаб связывается с рецептором CD4 и мешает нормальному взаимодействию вирусного белка gp120 с ним. Из-за этого вирус не «прилипает» к клеткам-мишеням и не может в них проникнуть.
по теме

Лечение
Лучшие научпоп-статьи 2018 года
После «прилипания» к рецептору CD4 клетки-хозяина вирусная частица взаимодействует еще с одним рецептором — CCR5 (или с CXCR4 — в зависимости от типа вируса), чтобы лучше закрепиться на поверхности клетки. На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина. Однако у ВИЧ все гены хранятся не в ДНК, как у людей, а в РНК. Поэтому вирус с помощью специального фермента — обратной транскриптазы — сначала должен переписать свои гены из собственной РНК в понятную нашим клеткам ДНК. Обратная транскриптаза работает как конвейер: захватывает отдельные нуклеозиды — строительные «кирпичики», из которых складывается ДНК, — и собирает их в готовую цепочку. А нужная (для воспроизводства вируса) последовательность кирпичиков-нуклеозидов при этом записана в исходной вирусной РНК.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
Разница между НИОТ и ННИОТ заключается в структуре молекул лекарств. Вещества первой группы по структуре похожи на нуклеозиды — те самые кирпичики, из которых строятся молекулы ДНК и РНК. Когда такой «неправильный кирпичик» попадает в «конвейер» обратной транскриптазы вируса, ее механизм «заклинивает», и она больше не может собирать вирусную ДНК. ННИОТ имеют другую структуру, непохожую на нормальные нуклеозиды, и блокируют обратную транскриптазу, связываясь с ее молекулой в других точках.
С этой особенностью строения связано и большее число побочных эффектов при приеме НИОТ по сравнению с ННИОТ: молекулы первого класса ингибиторов могут нарушать процессы синтеза РНК и ДНК и в наших собственных клетках, так как они похожи на «нормальные» нуклеозиды и тоже «заклинивают» наши собственные ферменты, но в гораздо меньшей степени, чем вирусные. НИОТ исторически были первым классом препаратов, которые начали использовать для лечения ВИЧ-инфекции.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Мутации помогают не только ВИЧ, но и некоторым людям. Например, мутация, изменяющая форму рецептора CCR5, который ВИЧ использует на первом этапе проникновения в клетку, делает человека полностью невосприимчивым к некоторым подтипам ВИЧ. Вирус не может «приклеиться» к такому рецептору и проникнуть в клетку. В разных популяциях людей распространенность этой мутации колеблется от 0,1 % до 1 %.
Несмотря на большое количество разных групп препаратов, используемых для торможения ВИЧ-инфекции, вылечить ее полностью пока невозможно. Проблема заключается в том, что все имеющиеся на сегодняшний день лекарства тормозят размножение вирусов в организме на разных этапах, но неспособны полностью удалить вирус из организма. Он всегда будет присутствовать в каком-то количестве клеток в «спящем режиме», встроившись в ДНК, и сразу же продолжит размножение, как только человек прекратит прием антиретровирусных препаратов.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Источник